Lição 31 e 32
20-10-2014
Sumário : Análise de um protocolo sobre observação macroscópicas de
colónias e microscópicas de esfregaços de bactérias.
Coloração simples e diferencial de bactérias
Continuação de elaboração da
ficha de trabalho sobre "prevenção e controlo e infeções relacionadas com
processamento das roupas hospitalares".
Introdução
No início da aula estivemos a falar sobre os meios de cultura , depois de
escrevemos os sumários em atraso a professora distribuiu uma ficha de
observação macroscópica e microscópica de culturas de bactérias e de seguida
explicou -a.
começamos a ler o
protocolo para saber o que iríamos fazer na próxima aula
Análizamos as culturas para ver havia desenvolvimentos e verificamos que na do ar havia mais colónias. Todos os grupos repetiram a inoculação de algumas culturas porque
houve erros na aula anterior. Ao misturar o meio ao inóculo como estava muito quente deve ter morto os microrganismos. Assim repetiu-se as culturas do sumo ;
mesa ; anéis e da moeda. Inocularam-se os meios, fecharam-se e guardaram-se para a próxima aula para verificarmos
se haverá melhores resultados do que na atividade anterior .
Aqui
está a ficha que a professora esteve a explicar .
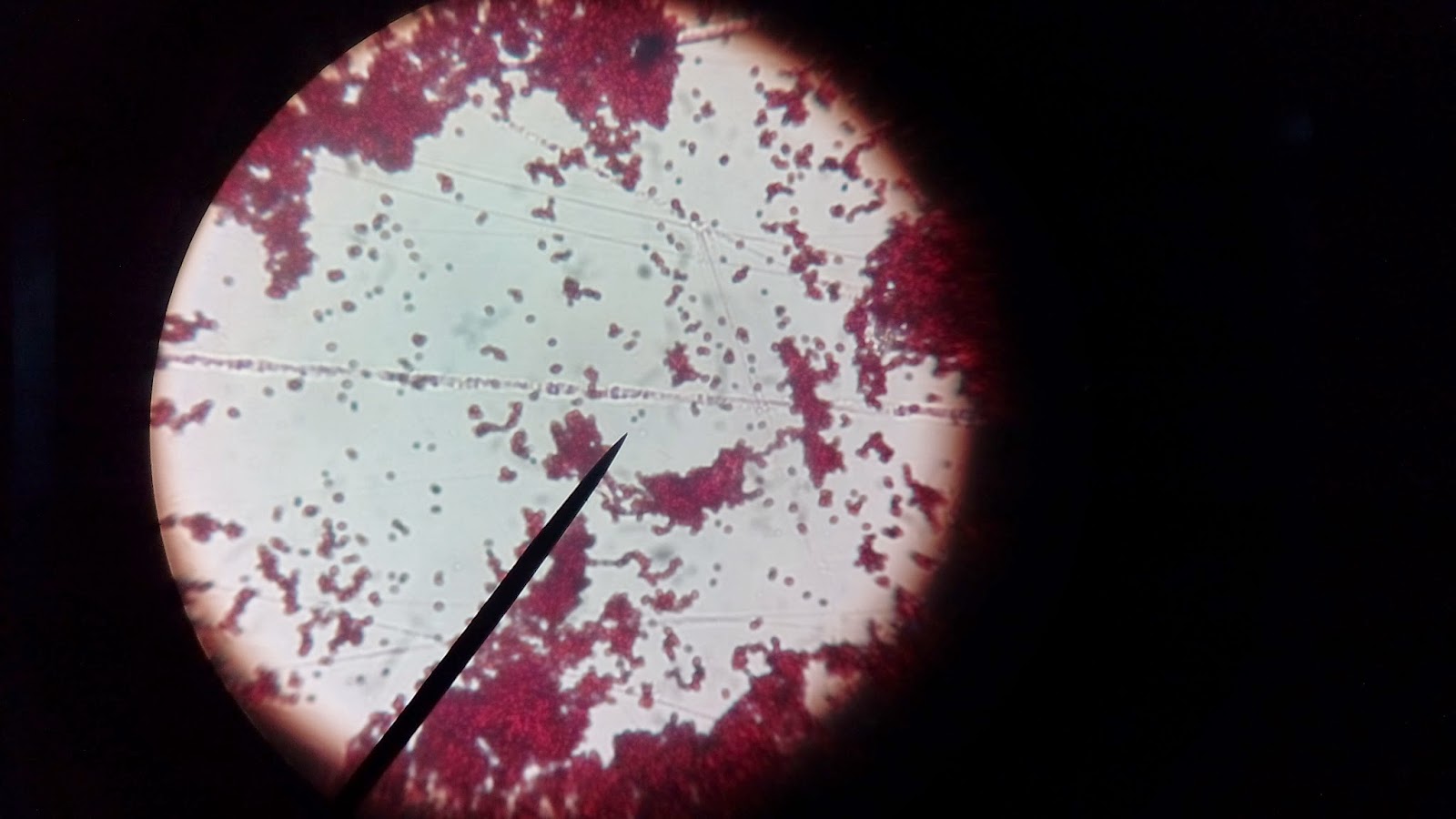
Observação macroscópica e microscópica de culturas de bactérias
A cultura de bactérias é o crescimento de colónias de microrganismos
induzida pelo Homem para facilitar o seu estudo. O meio de cultura é uma
substância líquida ou sólida, simples ou complexa, que permite a
nutrição, o crescimento e a multiplicação
dos microrganismos do inóculo. Os meios de cultura são seleccionados consoante
o tipo de bactéria a observar. As bactérias multiplicam-se em meios de cultura
apropriados desde que sejam respeitadas as condições de temperatura, pH,
humidade e composição.
Muitas delas podem
possuir esporos (formações que conferem resistência às bactérias), devido ao
meio ambiente inadequado à sua condição de vida. Esta é uma forma delas se manterem
vivas até encontrarem a condição ideal de sobrevivência. As bactérias
esporuladas não são mortas por desinfeção. Só a esterilização as elimina.

A figura 1 apresenta características macroscópicas de colónias de
bactérias quando crescem isoladas num meio de cultura sólido.
Uma colónia
pode ser classificada quanto à forma, quanto à margem e quanto à elevação, como
se vê no esquema, e ainda quanto à pigmentação (cor da colónia) e ao tamanho (ponto,
pequeno, médio ou grande).
Estas características
culturais podem servir para dividir os microrganismos em grupos taxonómicos.
Saber
descrever as colónias e contá-las são procedimentos úteis para a sua classificação.
1-
Seleccione uma placa com cultura de bactérias que
contenha poucas mas uma maior variedade
de colónias.
2-
Desenhe um círculo do tamanho da caixa de Petri e
esquematize as colónias.
3-
Classifique as colónias, de cada placa, de acordo com
as características macroscópicas apresentadas.( Utilize uma tabela para
organização dos dados).
1-
Seleccione outra cultura que contenha muitas colónias e
conte-as utilizando o contador de colónias .
Observação
microscópica
Embora existam milhares de espécies bacterianas diferentes, os organismos
isolados apresentam uma das três formas(fig.2) :
1. Elipsoidal ou Esférica (COCOS) - apresentam tipos e
arranjos diferentes:
·
diplococos - dois cocos;
·
estreptococos - vários cocos arranjados em
cadeias;
·
tétrades - cocos arranjados em 4 – quadrado;
·
estafilococos - cocos arranjados em cachos de
uva;
·
sarcina - cocos arranjados em forma cúbica;
2. Cilíndricas ou Bastonetes (BACILOS):
·
diplobacilos - ocorrem em pares ;
·
estreptobacilos - ocorrem em cadeias;
3. Espiraladas ou Elicoidais (ESPIRILOS) e VIBRIÕES- ocorrem predominantemente
como células isoladas.
É muito difícil
visualizar bactérias vivas, não só por serem muito pequenas mas também porque
são transparentes quando suspendidas em
meio aquoso. Para estudar propriedades e diferenciar microrganismos as técnicas
de coloração em conjugação com a microscopia óptica tornaram-se as melhores
ferramentas em microbiologia.
Todos os tipos de coloração requerem a obtenção prévia de esfregaços. A
técnica de obtenção de esfregaços , embora não seja difícil requer certos
cuidados na sua preparação.
Regras de preparação de
esfregaços
1-
Preparação das lâminas de vidro – a utilização de lâminas
bem limpas é fundamental para fazer esfregaços de microrganismos. Devem ser
lavadas com água e detergente e depois mergulhadas em álcool a 95%. Devem,
depois, ser secas e colocadas em toalhas de papel até serem usadas.
2-
Preparação do esfregaço (fig.3).- É essencial evitar esfregaços “grossos”. Um
bom esfregaço é aquele que quando seco se parece com uma fina película de papel
de acetato.
Existem duas modalidades de preparar esfregaços:
A- A partir de cultura em meio
sólido:
1- Colocar com a ansa uma pequena
gota de água sobre a lâmina;
2- Tocar ligeiramente com a ansa
esterilizada a superfície da cultura;
3- Suspender o material
recolhido na gota de água;
4- Estender a suspensão numa área
pequena em movimentos circulares de forma a que o esfregaço fique bem delgado
(quanto menor a espessura tanto mais simples será a observação).
A- A partir de uma cultura em
meio líquido: Procede-se de modo semelhante ao descrito no parágrafo anterior.
Não é necessário colocar água sobre a lâmina, fazendo-se o esfregaço
directamente com uma pequena gota de cultura. Isto também é aplicável aos casos
de materiais patológicos líquidos ou semilíquidos (pus de abcessos, escarro,
exsudados em geral, etc.). No caso em que existam poucas bactérias no meio,
poderá haver centrifugação prévia do material, fazendo-se o esfregaço com o
sedimento.
2-
Secagem do esfregaço: A secagem espontânea poderá ser acelerada agitando-se
a lâmina sobre a zona de ar quente por cima de um bico de Bunsen ou lâmpada.
Não se deve aquecer o esfregaço húmido a temperatura superior a que a mão possa
resistir.
1- Fixação pelo calor: Seco o esfregaço, passar
três vezes a lâmina sobre a parte mais quente do bico de Bunsen ou cinco vezes
na chama da lamparina. Durante esta operação, a face da lâmina contendo o
esfregaço deve estar voltada para cima. O movimento da mão sobre a chama deve
ser lento mas contínuo a fim de evitar que o esfregaço se carbonize. Deve-se segurar
a lâmina obliquamente e pelo extremo inferior, para não provocar queimadura ao
fixar a lâmina na chama. Esperar sempre que a lâmina arrefeça para iniciar qualquer
tipo de coloração.
Coloração de esfregaços
Existem variadas técnicas
de coloração baseadas em características morfológicas e estruturas celulares
para visualização, diferenciação e separação de bactérias. Os procedimentos
mais usados são os seguintes;
Coloração simples
A coloração simples (com um único corante) permite a
visualização da forma morfológica (cocos, bacilos, espirilos) e do arranjo (cadeias, cachos, pares,
tétradas) das bactérias
1- Prepare quatro esfregaços de quatro colónias diferentes.
2- Cubra cada esfregaço, utilizando um dos corantes a seguir indicados e usando o tempo de
exposição suficiente:
- fucsina fenicada- 30s;
- cristal de violeta – 1
minuto;
- azul de metileno -1 a 2 minutos;
- safranina- 1 minuto.
3- Lave o esfregaço em fio de água da
torneira para remover o corante excedente. Neste procedimento, a lâmina deve
ser colocada paralelamente ao fio da água da torneira, pois reduzir-se-á a
perda de microrganismos da preparação.
4- Limpe com cuidado a preparação,
utilizando papel de lentes(ou higiénico macio), sem esfregar.
5- Repita estes procedimentos para os
outros esfregaços, usando um corante diferente para cada um.
6- Examine todas as preparações em óleo
de imersão.(Nota: nenhum esfregaço deve
estar húmido para ser observado, pois não existe lamela sobre a lâmina e poderá
danificar as lentes).
Coloração de Gram
A coloração diferencial
requer o uso de, pelo menos, três reagentes químicos que são aplicados
sequencialmente no esfregaço fixado pelo calor. O primeiro reagente é chamado corante
inicial. A sua função é corar todas as células. Para estabelecer uma
coloração contrastante, o segundo reagente usado é um agente descorante
. Com base na constituição química dos componentes celulares , o agente
descorante pode ou não remover o corante inicial de todas as células ou apenas
de certas estruturas celulares. O reagente final, o contracorante ,
possui uma cor que contrasta com o corante inicial.
Após a descoloração, se o
corante inicial não foi removido da estrutura celular, o contracorante não pode
ser absorvido e a célula ou os seus componentes celulares reterão a cor do corante
inicial. Se o corante inicial for removido, os componentes celulares,
descorados, receberão a cor do corante contrastante. Neste caso, os tipos
celulares e as suas estruturas podem ser distinguidos, uns dos outros, com base
na cor apresentada.
A coloração diferencial
mais usada em bacteriologia, é a coloração de Gram, assim chamada em homenagem
ao seu descobridor, Dr. Christian Gram.
Esta técnica divide as
células bacterianas em dois grandes grupos, gram positivas e gram- negativas ,
sendo considerada o instrumento essencial para a classificação e diferenciação
dos microrganismos. O diferente comportamento das bactérias em relação a esta
técnica, descorar ou não o corante inicial, deve-se à diferente constituição da
parede celular.
A
coloração de Gram utiliza quatro reagentes diferentes. A seguir são descritos
esses reagentes e mecanismos de acção.
1- Corante inicial- Cristal de violeta- Este corante, violeta, é o primeiro a
ser usado e cora as células de azul- púrpura
2- Mordente- Iodina de Gram ou iodo de
Gram- Este reagente
serve como mordente que intensifica a cor do corante inicial e torna mais
difícil a remoção do corante nas bactérias gram positivas.
3- Agente descorante- Álcool etílico,
95%- Este reagente
possui uma dupla função: remove os lípidos existentes nas paredes bacterianas e
desidrata as proteínas também aí existentes. A retirada de lípidos, da parede ,
vai criar poros nessa parede celular e, como as bactérias gram negativas possuem lípidos em maior quantidade, esses
“buracos” vão ser maiores comparados com os das gram positivas .Por sua vez, a
desidratação das proteínas leva--as a tentarem fechar os poros deixados pela
saída dos lípidos. Nas bactérias gram positivas os poros abertos são “tapados “
pela desidratação das proteínas não deixando sair o corante inicial, enquanto
que nas gram negativas os poros são demasiado grandes deixando sair o corante e
ficando as células descoradas.
4º-
Contra corante- Safranina- É o reagente final para corar de vermelho as células que foram
previamente descoradas. Como só as células gram negativas ficaram descoradas estas
podem agora ser coradas pelo corante contrastante. As bactérias gram positivas
retêm a cor do 1º corante.
A preparação de esfregaços corados
adequadamente requer que se tomem as seguintes precauções:
1- O passo mais crítico do procedimento
é o passo de descoloração. Uma descoloração demasiada, resulta na perda de
corante inicial fazendo com que os organismos gram positivos apareçam gram
negativos. Por outro lado, uma descoloração pequena não removerá completamente
o corante nas gram negativas fazendo com que estas bactérias se apresentem gram
positivas. Seguindo à risca as instruções do procedimento ajudará a remediar
parte destas dificuldades, mas a experiência e prática individual, são a chave
para uma correcta descoloração.
2- É fundamental que as lâminas sejam
cuidadosamente lavadas em água corrente da torneira entre cada aplicação de
cada reagente. Este processo remove o reagente excedente e prepara a preparação
para a aplicação do reagente subsequente.
3- As melhores colorações de gram são
alcançadas com preparações de culturas jovens, não mais velhas do que 24 horas.
A idade das culturas, principalmente das células gram positivas,
influencia a coloração, pois estes organismos
tendem a perder a capacidade de reter o corante inicial e podem variar na
coloração de gram, isto é, algumas células aparecerão azuis , enquanto outras
aparecerão vermelhas.
Conclusão:
Não concluímos
a correcção da ficha porque não houve tempo ficou para a próxima aula .